Propriedades Específicas da Matéria
Parte 2 - Densidade
Videoaulas da professora Jack
As propriedades específicas da matéria são aquelas
próprias do material, geralmente não se repetindo em outros materiais. São
propriedades típicas que permitem a identificação de cada material.
As propriedades específicas podem ser divididas em
três tipos: organolépticas, físicas e químicas.
ALGUMAS PROPRIEDADES ESPECÍFICAS
FÍSICAS
1 – DENSIDADE
Considere que pegamos pedaços de diferentes
materiais que contêm volumes iguais. O que aconteceria caso puséssemos um a um
em uma balança eletrônica?
Observe a figura a seguir:

www.professorandrios.blogspot.com
Observe que no exemplo da figura, os blocos têm o
mesmo volume, mas suas massas são diferentes. O bloco de cobre tem massa maior,
indicando que naquele volume, existem mais moléculas juntas do que no mesmo
volume de cortiça, madeira ou ferro. Por que isso acontece?
Isso acontece devido à densidade.
A densidade é uma propriedade específica, ou seja,
ela é típica de cada material e permite que o material seja identificado e
diferenciado dos demais.
Ela demonstra o quanto existe de matéria em um
determinado espaço, indicando o quanto as moléculas estão mais juntas entre si
ou mais separadas.
Por exemplo:
Vamos fazer de conta que nossos corpos são
moléculas. Se todos nós da sala de aula entrássemos no armário da sala ou
fôssemos parar embaixo da mesa do professor, nós ficaríamos comprimidos,
apertados, bem próximos uns dos outros. Em outras palavras: alta densidade,
moléculas mais juntas;
Se, por outro lado, nos espalhássemos pela escola,
haveria espaços maiores entre nós, ficaríamos distanciados uns dos outros,
então a densidade seria baixa, moléculas menos juntas.
Portanto o cobre é
mais denso que o ferro, que é mais denso que a madeira que é mais densa que a
cortiça. Veja que interessante as figuras a seguir mostrando melhor essa
relação entre quantidade de matéria espaço: 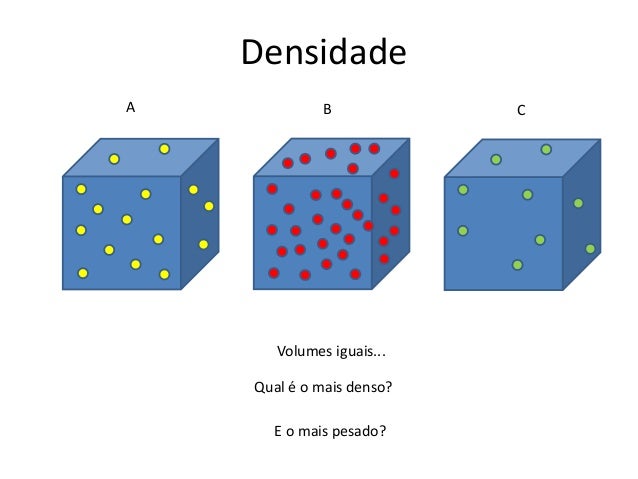
www.ptslideshare.net

www.feiradeciencias.com.br
Matematicamente, percebemos que, mantendo o volume, quanto maior a massa, maior a densidade e vice-versa, ou seja, a densidade é diretamente proporcional à massa.
Por outro lado, mantendo a massa, quanto maior o volume, menor será a densidade e vice-versa, então, a densidade é inversamente proporcional ao volume.
Temos que a densidade é a relação (portanto, divisão) entre a quantidade de matéria e o espaço que ela ocupa. Em outras palavras, densidade é a o resultado da divisão entre massa e volume. Veja a fórmula:

http://www.brasilescola.com/quimica/densidade.htm
A unidade de densidade no Sistema Internacional é o quilograma por metro cúbico (kg/m3), embora as unidades mais utilizadas sejam o grama por centímetro cúbico (g/cm3) ou o grama por mililitro (g/mL). Para gases, costuma ser expressa em gramas por litro (g/L).
É também devido à densidade que também sempre ouvimos aquela pergunta esperta: qual a diferença entre 1 Kg de chumbo e um 1 Kg de algodão?

Claro que os mais espertos sabem que 1 Kg de chumbo equivale a 1 Kg de algodão. Mas então, por que da pergunta?
Repare na figura:

www.mundovestibular.com.br
Para termos 1 Kg de algodão, precisamos de uma extensão/volume maior dele do que de chumbo. O mesmo acontece no nosso corpo com relação aos músculos e à gordura:

www.quimicanovestibular.wordpress.com.br
Uma dada massa de gordura ocupa um espaço/volume maior em nosso corpo do que a mesma massa de músculo.
Por que isso acontece?
Isso acontece devido à densidade.
A densidade é uma propriedade específica, ou seja, ela é típica de cada material e permite que o material seja identificado e diferenciado dos demais.
Ela demonstra o quanto existe de matéria em um determinado espaço, indicando o quanto as moléculas estão mais juntas entre si ou mais separadas.
Voltando ao caso do algodão e do chumbo: em 1 Kg de algodão e 1 Kg de chumbo temos quantidades equivalentes de matéria (massa), mas as moléculas do algodão estão menos juntas do que as do chumbo, portanto, ocupando um volume/espaço maior. A densidade do algodão é menor que a do chumbo, portanto, as moléculas estão mais separadas, ocupando mais espaço.
Se quiser, assista à videoaula a seguir que explica o que aparece até aqui:
https://www.youtube.com/watch?v=mr2Wvx-eZi8
Como densidade é uma propriedade específica e cada material possui a sua densidade, existem diversas tabelas contendo a densidade de diferentes materiais. Vejamos algumas:
Água .......................................0,997 g/cm3 = 1,0 g/cm3
Álcool etílico...........................0,789 g/cm3
Alumínio ................................ 2,70 g/cm3
Chumbo...................................11,3 g/cm3
Diamante ..................................3,5 g/cm3
Leite integral............................1,03 g/cm3
Mercúrio .................................13,6 g/cm3
Álcool etílico...........................0,789 g/cm3
Alumínio ................................ 2,70 g/cm3
Chumbo...................................11,3 g/cm3
Diamante ..................................3,5 g/cm3
Leite integral............................1,03 g/cm3
Mercúrio .................................13,6 g/cm3
http://www.mundoeducacao.com/quimica/densidade.htm
Leite integral...........................1,03 g/cm3
Alumínio ................................ 2,70 g/cm3
Diamante .................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Mercúrio .................................13,6 g/cm3
Alumínio ................................ 2,70 g/cm3
Diamante .................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Mercúrio .................................13,6 g/cm3
http://www.mundoeducacao.com/quimica/densidade.htm
Latão.................. 8,40 a 8,70
Bronze ............... 8,70 a 8,90
Petróleo ............. 0,76 a 0,85
Água do mar ...... 1,01 a 1,03
Água destilada......... 0,99823
SEE - SP. Material de apoio ao currículo do Estado de São Paulo: caderno do professor; Ciências.
Ensino Fundamental - anos finais, 9º ano, 2014 - 2017.
Cloreto de sódio...................... 2,17 g/cm3
Madeira balsa.............. 0,11 a 0,14 g/cm3
Bambu ................................... 0,31 a 0,40
Couro seco ....................................... 0,86
Manteiga ............................... 0,86 a 0,87
Borracha ............................... 0,91 a 1,25
Gelatina ........................................... 1,27
Osso ......................................... 1,7 a 2,0
Giz ............................................ 1,9 a 2,8
Areia ..................................... 2,14 a 2,36
Porcelana .................................. 2,3 a 2,5
Bola de gude ........................... 2,6 a 2,84
Granito ................................... 2,64 a 2,76
Diamante ........................................... 3,51
Cloreto de sódio...................... 2,17 g/cm3
Madeira balsa.............. 0,11 a 0,14 g/cm3
Bambu ................................... 0,31 a 0,40
Couro seco ....................................... 0,86
Manteiga ............................... 0,86 a 0,87
Borracha ............................... 0,91 a 1,25
Gelatina ........................................... 1,27
Osso ......................................... 1,7 a 2,0
Giz ............................................ 1,9 a 2,8
Areia ..................................... 2,14 a 2,36
Porcelana .................................. 2,3 a 2,5
Bola de gude ........................... 2,6 a 2,84
Granito ................................... 2,64 a 2,76
Diamante ........................................... 3,51
Nesta última tabela, perceba que o latão, o bronze, o petróleo e a água do mar não têm apenas uma densidade, mas sim uma faixa de densidades. Isso acontece porque se tratam de misturas de diferentes materiais. O bronze, por exemplo, é uma mistura de cobre e estanho, então, caso haja pequenas variações na quantidade de cobre ou de estanho colocado, a densidade do bronze varia um pouco. Já o latão é uma mistura de cobre e zinco e o petróleo é uma mistura de vários hidrocarbonetos, como veremos depois em outras postagens.
Densidade e flutuação de corpos
A densidade influencia na flutuação de corpos em líquidos e na mistura de uma substância com outra. Assista ao excelente vídeo da torre de líquidos do Manual do Mundo:
https://www.youtube.com/watch?v=6JCxDhOVKcM
Assista com muita atenção ao vídeo a seguir:
Você percebeu que o gelo flutua na água mas não flutua no álcool. Isso acontece porque o gelo é menos denso que a água, então ele flutua; só que o gelo é mais denso que o álcool, portanto ele afunda no álcool.
Assista à experiência a seguir:
https://www.youtube.com/watch?v=SrzhfDHIQc4
Você consegue agora explicar qual é o motivo do ovo afundar na água mas flutuar na água com sal?
E no caso da bolinha de massa de pão dentro de um copo com água: você consegue explicar o motivo dela flutuar quando a massa já está pronta para ir ao forno?

www.comidinhasdajuju.com
Já foi explicado em outra postagem que dentro da massa do pão ocorre uma reação química na qual o fermento, Saccharomyces cerevisiae libera gás carbônico dentro da massa fazendo-a aumentar o volume e deixando-a "mais leve". Na verdade, aumentando o volume da massa, o gás carbônico diminui a densidade dela então ela flutua na água, pois a massa de pão cheia de gás se torna menos densa do que a água.
Resumindo:
- o que é menos denso flutua
- o que é mais denso afunda
Para encerrarmos essas explicações sobre densidade, assista ao vídeo a seguir que mostra como usar a densidade para saber se a gasolina com a qual abastecemos nossos carros está alterada ou não:
https://www.youtube.com/watch?v=1u1f2NWBwVk
Alguns fatores que afetam a densidade
A densidade depende, em primeiro lugar, da substância ou do material considerado.
Em segundo lugar, a densidade de um mesmo material depende da temperatura. O ganho de calor causa a expansão, aumentando o volume, o que diminui a densidade. A perda de calor causa contração, diminuindo o volume o que vai aumentar a densidade.
As mudanças de estado físico também causam mudanças na densidade de uma substância. Por exemplo, a densidade da água no estado líquido é 1 g/cm3, enquanto que a densidade da água no estado sólido (gelo) é de 0,92 g/cm3.
Que tal uma música?
A seguir, uma paródia sobre densidade, para animar e auxiliar na aprendizagem:
https://www.youtube.com/results?search_query=par%C3%B3dia+densidade
Exercícios sobre densidade:
Lista 1 -
1 - Calcule a densidade de 35 g de uma substância que ocupa 2,5 cm3.
2 - Qual o volume ocupado por 3,5 g de ouro, sabendo que sua densidade é de 19,3 g/cm3?
3 - Qual a massa de 150 cm3 sabendo que sua densidade é de 0,97 g/cm3?
4 -Qual a densidade de 5,9 g de uma substância que ocupa 7 cm3 de volume?
5 - Qual o volume ocupado por 54 g de alumínio, sabendo que sua densidade é 2,7 g/cm3.
6 - Qual a massa de 1,2 L de água, sabendo que sua densidade é de 1 g/cm3?
7 - Sabendo que a densidade absoluta do ferro é de 7,8 g/cm3, determine a massa de uma chapa de ferro de volume igual a 650 cm3.
8 - A densidade absoluta da gasolina é de 0,7 g/cm3. Qual o volume ocupado por 420 g de gasolina?
9 - Calcular a densidade do mercúrio, sabendo que 1360 g ocupam o volume de 100 cm3.
10 - Um béquer contendo 400 cm3 de um líquido com densidade de 1,85 g/cm3 pesou 884 g. Qual a massa do béquer vazio?
11 - A densidade do diamante é igual a 3,5 g/cm3. A unidade internacional para pesagem de diamantes é o quilate, que corresponde a 200 mg. Qual o volume de um diamante de 1,5 quilates?
12 - Quando se deixa cair uma peça de metal com massa igual a 112,32 g em um cilindro graduado (proveta) que contém 23,45 mL de água, o nível sobe para 29,27 mL. Qual a densidade do metal em g/cm3?
13 - Qual o volume, em litros, ocupado por 5 g de prata sólida, cuja densidade é igual a 10,5 g/cm3?
14 - Um líquido,com volume de 10,7 mL, tem massa igual a 9,42 g. O líquido pode ser octano, etanol ou benzeno, cujas densidades são, respectivamente (em g/cm3), 0,702, 0,789 e 0,879. Qual o líquido em questão? Justifique sua resposta através de cálculos.
15 - Um sólido flutuará num líquido que for mais denso que ele. O volume de uma amostra de calcita, pesando 35,6 g, é 12,9 cm3. Em qual dos seguintes líquido haverá flutuação da calcita:
- tetracloreto de carbono (d= 1,60 g/cm3)
- brometo de metileno (d= 2,50 g/cm3)
- tetrabromo-etano (d= 2,96 g/cm3)
- iodeto de metileno (d= 3,33 g/cm3)
Justifique sua resposta através de cálculos.
16 - Um bloco de ferro (d= 7,6 g/cm3) tem as seguintes dimensões: 20 cm x 30 cm x 15 cm. Determine a massa, em Kg, do bloco.
Lista 2 -
1 - Em três Erlenmeyers denominados como A, B, C, foram colocadas massas iguais dos líquidos incolores benzeno (d= 0,88 g/cm3), água (d= 1,0 g/cm3) e clorofórmio (d= 1,49 g/cm3), um em cada frasco. Observe o desenho abaixo, que mostra os três frascos, e conclua qual o líquido colocado em cada um. Justifique sua resposta.
www.brainly.com.br
2 - Um ovo de galinha inteiro e cru foi colocado em um recipiente com água e afundou. Após dissolver algumas colheradas de sal na água, o ovo passou a flutuar no líquido.
a) Por que o ovo inicialmente afunda?
b) A densidade do ovo se altera durante o experimento?
c) Explique por que o ovo passa a flutuar após a adição do sal na água.
3 - Vários pequenos pedaços de dois materiais sólidos estão misturados. Um desses materiais tem densidade 1,2 g/cm3 e outro, 2,7 g/cm3. Explique como um líquido de densidade 1,6 g/cm3, que não dissolve nem danifica esses sólidos, pode ser útil para separá-los.
4 - Um estudante desejava medir o volume de um parafuso grande. Para isso, colocou água em uma proveta e leu o volume. Em seguida, colocou o parafuso dentro da proveta com água e viu novamente o volume. Utilizando-se do desenho abaixo, responda:
www.cienciasleituraeadrenalina.blogspot.com
a) Qual é o volume do parafuso?
b) Sabendo que a massa do parafuso é 157,4g determine a densidade do material de que ele é feito em g/cm3.
5 - Uma cena de filme mostra um ladrão colocando dez barras de ouro, de volume 1 L cada (equiparável ao de uma embalagem de leite longa vida), dentro de um saco de pano e, a seguir, sair correndo do local do crime.
Considerando que a densidade do ouro é 19,3 g/cm3 e que 1 L = 1000 cm3, responda:
a) Qual a massa do ouro roubado?
b) Admitindo que o saco de pano aguente, seria possível o ladrão correr com o que roubou?
6 - 100 cm3 de chumbo tem massa de 1130 g enquanto que 100 cm3 de chumbo, 1930 g. Qual das duas substâncias é mais densa? Calcule a densidade de ambas.
7 - Qual a densidade de um corpo com 6 Kg de massa e volume de 0,5 L?
8 - O que tem maior densidade: 1 g de água ou 10 Kg de água? Uma barra de ouro puro ou um anel de ouro puro? Justifique sua resposta.
9 - Sabendo que a densidade do metal chumbo é de 11,3 g/cm3 e a do material conhecido como isopor é de 0,4 g/cm3, diga o que deve ocupar maior volume: 10 g de chumbo ou 10 g de isopor? Justifique sua resposta.
10 - O álcool comum tem densidade igual a 0,8 g/cm3 e a água, igual a 1,0 g/cm3. O que tem maior massa: 1 L de álcool ou 1 L de água? E o que tem maior volume: 1 Kg de álcool ou 1 Kg de água?
11 - A densidade do ferro é 7,86 g/cm3. Qual é a massa de 100 cm3 de ferro?
12 - Sabendo que a densidade da água é de 1,0 g/cm3, a do gelo é de 0,9 g/cm3, a do álcool comum é de 0,8 g/cm3 e a do mercúrio é de 13,6 g/cm3, responda no caderno:
a) o gelo e o mercúrio afundam ou flutuam na água? Justifique sua resposta.
b) O gelo e o mercúrio afundam ou flutuam no álcool? Justifique sua resposta.
c) O que tem maior massa: 10 cm3 de mercúrio ou 10 cm3 de gelo? Por quê?
13 - O que tem maior volume: 1 Kg de chumbo (d= 11,3 g/cm3) ou 1 Kg de alumínio (d= 2,7 g/cm3)? Efetue os cálculos e responda.
14 - A densidade do mercúrio é de 13,6 Kg/L e a do álcool é de 0,8 Kg/L. O que tem maior massa: 1 L de mercúrio ou 10 L de álcool? Efetue os cálculos para responder.
15 - Uma pessoa afirma que o chumbo é mais pesado que o ferro. O que ela deve dizer para expressar corretamente o seu pensamento?
Lista 3 -
1 – Qual a fórmula para calcular a densidade? O que significa cada letra?
2 – Imagine uma bola feita de chumbo que tenha 1 Kg de massa. Pensou?
Agora, imagine uma bola feita de algodão que também tenha 1 Kg de massa... pense...
Qual a diferença entre as duas? Por que existe essa diferença?
3 – Faça diferente dessa vez: imagine uma caixa de leite longa vida (com 1L de volume) cheia de chumbo. Vamos, imagine! Agora, imagine outra caixa de leite longa vida com 1 L de algodão. Qual seria a diferença entre as duas? Justifique.
4 – O ouro tem densidade de 19,3 g/cm3 e a platina tem densidade de 21,4 g/cm3. Pergunta-se:
a) quem tem maior densidade, o ouro ou a platina? O que isso significa?
b) o que teria maior massa: 1 L de outro ou 1 L de platina? Justifique.
c) o que teria um volume maior (ocuparia mais espaço): 1 Kg de ouro ou 1 Kg de platina? Justifique.
d) o que teria maior massa: 2,0 cm3 de platina ou 4,0 cm3 de ouro. Calcule para responder.
5 – José Pedro comprou uma barra de chocolate e deixou na mochila. Com o calor, a barra de chocolate sofreu algumas alterações. Sobre esse fato, responda:
a) qual seria a ação do calor sobre as moléculas da barra de chocolate?
b) o que aconteceria com a massa dessa barra?
c) o que aconteceria com o volume da barra?
d) o que ocorreria com a densidade da barra de chocolate? Justifique.
6 – Isadora, muito desconfiada, foi fazer a experiência do ovo no copo com água apresentada pela professora. Ela pôs o ovo no copo com água e o ovo afundou. Depois em outro copo, pôs água com sal e, ao colocar o ovo, este flutuou. Explique o motivo desse fatos terem ocorrido.
7 – Um corpo tem 200 g de massa e 50 cm3 de volume. Calcule sua densidade.
8 – Qual é o volume ocupado por 35 g de mercúrio, sabendo que sua densidade é de 13,6 g/cm3?
9 – Qual a massa de 20 cm3 de ferro, sabendo que sua densidade é de 7,6 g/cm3?
10- Se um corpo tem a massa de 20 g em um volume de 5 cm3, qual é a sua densidade ?
11 - Determine a massa de um corpo cuja densidade é de 5 g/cm3 em um volume de 3 cm3.
12 - Bromo é um líquido vermelho acastanhado com densidade de 3,10 g/mL. Que volume ocupa uma amostra de 88,5 g de bromo?
13 - A densidade do selênio é 4,79 g/cm3. Qual a massa de 6,5 cm3 de selênio?
14 - Qual a massa de uma chapa de ferro de volume 650cm3 ? (A densidade do ferro é 7,8 g / cm3)
15 - A densidade da gasolina é 0,7 g / cm3. Qual o volume ocupado por 420 g de gasolina?
16 - A densidade do mercúrio é 13,6 g / cm3. Calcule o volume ocupado por 680 g dessa substância.
17 - Qual é o volume ocupado por 56,5g de chumbo? (d=11,3g/ cm3)
18 - Se 50 cm3 de fósforo vermelho possuem a massa de 110 g, então, qual é a sua densidade?
19 - O ácido sulfúrico (H2SO4) apresenta densidade igual a 1,84 g/cm3 a 20ºC. Para se obter 184 g do mesmo, qual é o volume necessário?
20 - Qual é o volume, em litros, de 1930g de ouro? (Dado: d = 19,3g/m3)
21 – A Ellen pegou uma proveta e colocou 80 mL de água nela. Depois, pegou um parafuso e colocou na proveta com água e o nível da água subiu para 100 mL. Sobre esses fatos, responda:
a) Qual é o volume do parafuso em cm3?
b) Sabendo que a massa do parafuso é de 157,4 g, determine a densidade do material de que ele é feito.
22 – A charge mostra um navio petroleiro afundando, com vazamento de petróleo no mar.
a) Use seus conhecimentos sobre densidade para explicar
porque um navio flutua se estiver com seu casco intacto, mas afunda caso ele
sofra algum rompimento.
b) Existe um erro científico na ilustração ao lado. Qual é
esse erro?
23 – Marcelo assistiu a um filme que mostra um ladrão colocando dez barras de outro, de volume 1 L cada, dentro de um saco de pano e, a seguir, sair correndo do local do crime. Considerando que a densidade do ouro é de 19,3 g/cm3 e que 1L equivale a 1000 cm3, responda:
a) Qual a massa do ouro roubado?
b) O que você conclui sobre a fuga do ladrão com o ouro roubado?
24 – Raí estava sofrendo com o calor. Pegou uma latinha de refrigerante e colocou no congelador para gelar mais rápido, só que ele a esqueceu lá. Quando lembrou, ao abrir o congelador, encontrou a latinha estufada, com o lacre rompido e parte do refrigerante esparramado pelo congelador. Levou uma bronca de sua mãe, foi então que lembrou das aulas de Ciências e começou a explicar para a mãe o que havia acontecido com o refrigerante. A mãe ficou tão impressionada que até se esqueceu de continuar a bronca. Qual foi a explicação oferecida por Raí para sua mãe?
24 – Foi explicado na aula que os corpos sólidos tem moléculas mais juntas que os corpos líquidos, portanto, os corpos sólidos são mais densos que os corpos líquidos. Se isso está correto, por que os gigantescos icebergs (água no estado sólido) flutuam na água?
25 – Analise a tabela abaixo e responda as questões que vem a seguir:
Substância/Material Densidade g/cm3
Mercúrio 13,5
Chumbo 11,3
Iodo 4,9
Água 1,0
Bambu 0,4
Manteiga 0,86
a) quais as substâncias/materiais que flutuariam na água? Justifique.
b) quais as substâncias/materiais que afundariam na água? Justifique.
26 – David foi à piscina com seus colegas. Um deles estava com medo de entrar na água pois não sabia nadar. Baseando-se nas aulas de Ciências, David pegou duas garrafas PET de 2L vazias, tampou-as e deu para o seu amigo que as abraçou e foi para a piscina. A surpresa foi que seu colega flutuou agarrado às garrafas. Explique como isso é possível.
Lista 4 -
1 - (VUNESP 2009) EMBRAER Os acidentes envolvendo derramamento de petróleo, embora dramáticos e causadores de impactos ambientais gravíssimos, têm como lado positivo o fato de a mancha de óleo permanecer na superfície. Dessa forma, a mancha pode ser contida e recolhida por meio de bombas de sucção. O petróleo fica na superfície da água por que
a) sua densidade é menor que a da água.
b) é uma mistura homogênea bifásica.
c) apresenta peso maior que o da água.
d) é separado por destilação fracionada.
2 - (EMBRAER - 2010) Em uma atividade de laboratório para estudar o assunto densidade, os alunos realizaram um teste para saber em qual dos líquidos propostos pelo professor uma moeda de cobre poderia flutuar. Para realização dessa prática, foi fornecida aos alunos uma tabela com a densidade dos materiais utilizados.
Lista 4 -
1 - (VUNESP 2009) EMBRAER Os acidentes envolvendo derramamento de petróleo, embora dramáticos e causadores de impactos ambientais gravíssimos, têm como lado positivo o fato de a mancha de óleo permanecer na superfície. Dessa forma, a mancha pode ser contida e recolhida por meio de bombas de sucção. O petróleo fica na superfície da água por que
a) sua densidade é menor que a da água.
b) é uma mistura homogênea bifásica.
c) apresenta peso maior que o da água.
d) é separado por destilação fracionada.
2 - (EMBRAER - 2010) Em uma atividade de laboratório para estudar o assunto densidade, os alunos realizaram um teste para saber em qual dos líquidos propostos pelo professor uma moeda de cobre poderia flutuar. Para realização dessa prática, foi fornecida aos alunos uma tabela com a densidade dos materiais utilizados.
A moeda de cobre deve flutuar no recipiente que
contém:
a) água.
b) leite integral.
c) mercúrio.
d) álcool etílico.
3 - (EMBRAER 2012) Uma forma de se identificar um sólido é por meio de sua densidade.
Por exemplo, a densidade do ouro é de 19,3 g/cm3
, enquanto
a do cobre é de 8,9 g/cm3
. Uma peça metálica foi fabricada
utilizando o mesmo volume de ouro e de cobre, ou seja, 50%
do volume da peça era de ouro e 50% era de cobre.
A massa de cobre utilizada na fabricação dessa peça metálica
(A) corresponde ao valor de 8,9 g.
(B) é menor do que o valor da massa do ouro.
(C) é maior do que o valor da massa do ouro.
(D) representa 50% da massa total da peça.
4 - (EMBRAER 2013) . Em uma aula de Ciências, o professor apresentou aos alunos
um experimento sobre flutuabilidade. Para isso, colocou ovo
de galinha em dois frascos contendo, em um deles, água salgada
e, em outro, água da torneira.
O resultado pode ser observado na ilustração a seguir.
Uma explicação correta para esse resultado é:
(A) o ovo que se encontra no frasco 2 é mais pesado.
(B) os líquidos dos frascos apresentam densidades diferentes.
(C) o ovo e a água salgada apresentam a mesma densidade.
(D) a relação entre o peso do líquido e do ovo é menor no
frasco 1.
5 - (ETEC 2010) Marcelo e seu irmão alugaram uma casa de praia e, chegando ao local, frustraram-se ao ver a areia e o mar
cheios de manchas de petróleo.
Quando toneladas de petróleo são despejadas no oceano, geralmente por negligência humana, ondas de óleo
aparecem nas praias, nas encostas pedregosas e nos portos, e vários animais são cobertos por uma fina e
grudenta camada de óleo, sucumbindo a uma morte lenta e agonizante.
Essas grandes manchas negras, que se formam sobre a superfície dos oceanos, ocorrem porque o petróleo
(A) forma precipitado com a água do mar.
(B) tem menor densidade que a água do mar e é insolúvel nesse meio.
(C) tem maior densidade que a água do mar e é solúvel nesse meio.
(D) forma mistura homogênea com a água do mar.
(E) reage com a água do mar formando uma substância negra.
6 - (EMBRAER 2014) Na preparação de massa de um pão, foram utilizados os
seguintes ingredientes: farinha de trigo, água, fermento
biológico, açúcar, sal e ovo. Após a mistura dos ingredientes
e antes de levar a massa ao forno, foi retirada
uma colherada da massa e colocada em um copo com
água, conforme ilustração. Após a massa subir no copo
com água, ela foi levada ao forno para assar
O fenômeno da subida da massa de pão no copo com
água está relacionado com a ocorrência de um processo
biológico realizado pelo fermento biológico, que resulta
na produção de gás carbônico. Com isso, há uma alteração na densidade, uma vez que ocorre
(A) aumento de massa.
(B) aumento do volume.
(C) diminuição da massa.
(D) diminuição do volume.










