Constituição da Matéria - Do que as coisas são feitas (parte 2)
Substâncias puras, soluções e misturas homogêneas e heterogêneas
Assim como a tendência dos elementos químicos combinarem-se entre si formando as substâncias (com exceção dos gases nobres), as substâncias também, dificilmente, são encontradas puras no ambiente.
Mesmo a água de uma mina, ou a água que pegamos no filtro, não está pura. Mesmo o ar que respiramos é uma mistura!
A tendência das substâncias é estar junto com outras, formado misturas.
No caso da água, mesmo filtrada, ela vem com uma série de sais minerais dissolvidos nela, como bicarbonato de sódio, cloreto de sódio, etc. Veja o rótulo de garrafinha de água mineral a seguir:
www.arquerts.com.br
A água, para ser pura, deve passar pelo processo de destilação, onde será purificada de sais dissolvidos e de compostos orgânicos que possam estar presentes.
A água de minas naturais também não são puras. Ela possui, além de muitos sais, a presença de vários micro-organismos, inclusive alguns patogênicos.
O ar que inspiramos, por exemplo, é uma mistura de gases: 78% de nitrogênio, 21% de oxigênio, 1% de outros gases, inclusive, dióxido de carbono (0,035%).
Outro exemplo interessante é a das ligas de ouro utilizadas na confecção de joias.
O ouro puro é denominado ouro 1000 ou 24 quilates(24K). Na realidade, o ouro nunca tem uma pureza total, e a classificação mais alta cai para 999 pontos. O ouro 24K que chamamos de 100% puro equivale a 999 pontos na escala européia. O ouro 18K, que tem uma pureza de 75%, equivale a 750 pontos. Aplicado ao ouro, entretanto, o quilate é uma medida de pureza do metal, e não de massa. É a razão entre a massa de ouro presente e a massa total da peça, multiplicada por 24, sendo cada unidade de quilate equivalente a 4,1666 % em pontos percentuais de ouro do total.
Desta forma, o ouro 18 quilates tem 75% de ouro, e o restante são ligas metálicas adicionadas fundindo-se o ouro com esses metais num processo conhecido como quintagem, para garantir maior durabilidade e brilho à joia.
Os elementos dessas ligas geralmente adicionados ao ouro podem variar muito em função da cor, ou ponto de fusão desejados e em algumas joalherias, essa fórmula é mantida como segredo industrial. Os metais mais comuns utilizados nessas ligas são o cobre, a prata, o zinco, o níquel, o cádmio, resultando em um ouro com coloração amarela. Existe também o ouro branco, que é feito com ligas utilizando o paládio que tem efeito descoloridor, nesse caso o ouro branco no processo final de acabamento a joia é submetida a um banho de ródio.
O álcool que compramos no supermercado, também é uma mistura de álcool etílico e água. Quando você olha no rótulo e o álcool é de 46º de teor, significa que em cada 1 litro daquele álcool, 460 mL é de álcool e os outros 640 mL é de água!
Muitos exemplos poderiam ser dados: os materiais que formam os corpos dos seres vivos, o petróleo, os remédios, os alimentos, etc.
As misturas podem ser classificadas em misturas homogêneas e misturas heterogêneas.
homos = do grego, significa igual;
heteros = do grego, significa diferente.
As misturas heterogêneas são aquelas perceptíveis de alguma maneira através do sentido da visão, principalmente, pois formam mais de uma fase. Fases são as partes perceptíveis em uma mistura.
Conforme o número de fases, uma mistura heterogênea pode ser classificada em:
Bifásica: onde duas fases são percebidas, como no caso das misturas a seguir:

http://candidopedrosa.blogspot.com.br/2013/04/revisao-de-quimica-parte-2.html
Mistura bifásica de feijão preto e grãos de milho.
http://tudodeconcursosevestibulares.blogspot.com.br/2013/03/misturas-e-substancias-resumo.html
Mistura bifásica de óleo e água.
Os refrigerantes são misturas bifásicas de refrigerante (que é uma mistura homogênea de várias substâncias) mais o gás carbônico que forma as bolhas.
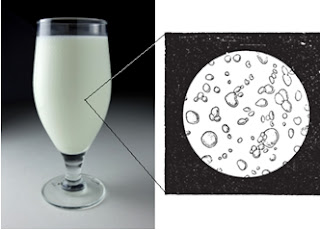
O próprio leite pode ser considerado uma mistura bifásica, quando a nata fica na parte superior. Aliás, colocado em uma lupa, é possível verificar no leite as gotículas de gordura.
www.mundodaeducação.com.br
Trifásica: mistura heterogênea onde podem ser percebidas três fases. Veja os exemplos:
Sangue colhido no tubo de ensaio e deixado em repouso, apresenta três fases
www.alunosonline.uol.com.br (modificada)
Veja a seguir a mistura heterogênea trifásica de óleo + água + terra
www.alunosonline.uol.com.br
Quando a gente analisa um pedacinho de granito, também observamos misturas heterogêneas com cristais de minerais diferentes como mica, quartzo, feldspato, etc.
www.doceobra.com.br
Após essas explicações sobre misturas heterogêneas, é hora de apresentar as misturas homogêneas, que também podem ser chamadas de soluções.
As mistura homogêneas são monofásicas, pois suas substâncias misturam-se bem e uma dilui a(s) outra(s). Qualquer porção de uma mistura homogênea apresenta o mesmo aspecto e a mesma composição química.Nas misturas homogêneas ou soluções, podemos algumas vezes classificar seus componentes em solvente e soluto.
Solvente - substância que dissolve as demais. Na maioria das soluções líquidas, a água é o solvente.
Soluto - substância que é dissolvida pelo solvente.
Mas existem soluções gasosas, como o ar que respiramos; misturas homogêneas ou soluções sólidas, como as ligas metálicas (latão = cobre + zinco), amálgama dental (mercúrio + prata + estanho + zinco + cobre).
A solubilidade é a propriedade específica química que um material (substância) tem de se dissolver em outra. A solubilidade depende das substâncias envolvidas na mistura, das quantidades de solvente e soluto colocados, da temperatura e da pressão em que a mistura ocorrerá.
Por exemplo: se misturamos uma colher de chá de açúcar em um copo de água, haverá dissolução completa. Mas se continuarmos colocando mais colheres de açúcar, vai chegar um momento em que a água não dissolverá todo o açúcar e uma parte dele se depositará no fundo.
Vamos resumir todo esse estudo na análise de uma figura:
https://pt.slideshare.net/McAlefJoanes/misturas-qumicas
No primeiro frasco, pode haver apenas uma substância ou uma mistura homogênea, portanto monofásica.
No segundo frasco, há uma mistura heterogênea com duas fases.
No terceiro, uma mistura heterogênea trifásica.
No quarto frasco, uma mistura heterogênea de quatro fases.
Para você que quer mais para entender melhor, assista às videoaulas a seguir:
https://www.youtube.com/watch?v=hCYGjcQAZhs
https://www.youtube.com/watch?v=JsYy-sDnH5I
Agora, hora de reagir, como diz o Prof. Paulo Valim!
Vamos em frente que a vida é luta! Exercícios!!!!
EXERCÍCIOS: SUBSTÂNCIAS PURAS E MISTURAS
1 - Copie no caderno as representações
abaixo e diga qual é elemento químico, qual é substância pura simples e qual é
substância pura composta:
a) H2
b) Cl2
c) N2
d) CH4
e) MgCl2
f) H2O
g) H2O2
b) Cl2
c) N2
d) CH4
e) MgCl2
f) H2O
g) H2O2
h) CCl4
i) Na2O
j) NaCl
k) O2
l) H
m) HCl
i) Na2O
j) NaCl
k) O2
l) H
m) HCl
n) O
o) N
o) N
2 – Copie os itens abaixo e classifique-os em mistura ou
substância pura:
a. Água dos rios;
b. Ferro;
c. Aço (ferro,
carbono, cromo e níquel)
d. Gás carbônico;
e. Salmoura (água, sal);
f. Refrigerante;
g. Leite;
h. Vinagre (água, ácido acético)
i. Ouro 18 quilates (ouro, ligas
metálicas)
j. Amálgama (liga de mercúrio, prata e
zinco);
k. Ar atmosférico;
l. Água destilada;
m. Gás nitrogênio;
n. Cobre;
o. Gás oxigênio.
3 - Analise os desenhos abaixo. Classifique cada um em substância pura ou mistura.
4 - Analise cada uma das representações a seguir e responda com atenção:
a) quantos átomos ela tem?
b) quantos elementos diferentes tem?
c) quantas substâncias diferentes têm?
d) é substância pura
ou mistura?
5 - Para cada uma das representações
abaixo diga se é mistura, ou substância simples ou substância composta:
6 - Analise as afirmativas abaixo e depois selecione a alternativa que contem todas afirmativas corretas:
I – o Universo é composto por matéria e energia;
II – Matéria é tudo que tem massa e ocupa lugar;
III – A matéria é composta por átomos;
IV – Os diferentes tipos de átomos são os elementos químicos da tabela periódica;
V – Os níveis crescentes de organização da matéria são: átomos/elementos químicos – substâncias/moléculas – misturas
a) Apenas I, II, III
b) Apenas II, III, IV
c) Apenas III, IV, V
d) Todas as afirmativas são corretas
7 - (PUC - SP) O conceito de elemento químico está mais relacionado com a ideia de:
a) átomo.
b) molécula.
c) íon.
d) substância pura.
e) substância natural.
8) (FMU - SP) A água destilada (purificada) é um exemplo de:
a) substância simples.
b) composto químico
c) mistura homogênea.
d) elemento químico.
e) mistura heterogênea.
9 - (UFF-RJ) Assinale a opção que apresenta apenas substâncias simples:
a) H2, Cl2, N2, CH4
b) MgCl2, H2O, H2O2, CCl4
c) Na2O, NaCl, H2, O2
d) CCl4, H2O, Cl2, HCl
e) H2, Cl2, O2, N2.
10 - (CESGRANRIO-RJ) Das alternativas abaixo, indique a única onde são mencionadas apenas substâncias compostas:
a) He, Ne, Ar, Kr, Xe
b) S8, Cl2
c) F2, Cl2, Br2, I2
d) O3, I2
e) H2O, H2S, H2Se
11 - (Osec-SP) Em qual das sequências abaixo estão representados um elemento, uma substância simples e uma substância composta, respectivamente:
a)H2, Cℓ2, O2
b)H2, Ne, H2O
c) H2, HI, He
d)H2O, O2, H2
e)Cℓ, N2, HI
12 - (Ufac) Com relação às substâncias O2, H2, H2O, Pb, CO2, O3, CaO e S8, podemos afirmar que:
I – o Universo é composto por matéria e energia;
II – Matéria é tudo que tem massa e ocupa lugar;
III – A matéria é composta por átomos;
IV – Os diferentes tipos de átomos são os elementos químicos da tabela periódica;
V – Os níveis crescentes de organização da matéria são: átomos/elementos químicos – substâncias/moléculas – misturas
a) Apenas I, II, III
b) Apenas II, III, IV
c) Apenas III, IV, V
d) Todas as afirmativas são corretas
7 - (PUC - SP) O conceito de elemento químico está mais relacionado com a ideia de:
a) átomo.
b) molécula.
c) íon.
d) substância pura.
e) substância natural.
8) (FMU - SP) A água destilada (purificada) é um exemplo de:
a) substância simples.
b) composto químico
c) mistura homogênea.
d) elemento químico.
e) mistura heterogênea.
9 - (UFF-RJ) Assinale a opção que apresenta apenas substâncias simples:
a) H2, Cl2, N2, CH4
b) MgCl2, H2O, H2O2, CCl4
c) Na2O, NaCl, H2, O2
d) CCl4, H2O, Cl2, HCl
e) H2, Cl2, O2, N2.
10 - (CESGRANRIO-RJ) Das alternativas abaixo, indique a única onde são mencionadas apenas substâncias compostas:
a) He, Ne, Ar, Kr, Xe
b) S8, Cl2
c) F2, Cl2, Br2, I2
d) O3, I2
e) H2O, H2S, H2Se
11 - (Osec-SP) Em qual das sequências abaixo estão representados um elemento, uma substância simples e uma substância composta, respectivamente:
a)H2, Cℓ2, O2
b)H2, Ne, H2O
c) H2, HI, He
d)H2O, O2, H2
e)Cℓ, N2, HI
12 - (Ufac) Com relação às substâncias O2, H2, H2O, Pb, CO2, O3, CaO e S8, podemos afirmar que:
a) todas são substâncias simples.
b) somente O2, H2 e O3 são substâncias simples.
c) todas são substâncias compostas.
d) somente CO2, CaO e S8 são substâncias compostas.
e) as substâncias O2, H2, Pb, O3 e S8 são simples.
13 - (UF-SC) Na natureza, as três classes gerais em que todas as formas de matéria podem ser divididas são: elementos, substâncias e misturas. Dados os materiais:
I. Ouro
II.Leite
III. Cloreto de sódio
quais deles constituem, respectivamente, uma mistura, uma substância e um elemento ?
a) I, II, III
b) II, III, I
c) II, I, III
d) III, I, II
e) I, III, II
14 - (FGV) Assinale a alternativa que preenche corretamente as lacunas.
“Sendo C4H8O a fórmula molecular da butanona, pode-se afirmar que há treze ....................... em cada ............................ da referida substância.”
a) átomos – molécula
b) moléculas - átomo
c) íons – molécula
d) moléculas - íon
e) átomos – íon
15 - (CESGRANRIO-RJ) A molécula da água apresenta:
a) uma molécula de hidrogênio e meia molécula de oxigênio.
b) uma molécula de hidrogênio e um átomo de oxigênio.
c) dois átomos de hidrogênio e um átomo de oxigênio.
d) meia molécula de hidrogênio e meia molécula de oxigênio.
e) as substâncias hidrogênio e oxigênio.
16 - Dado o sistema:

qual é o número de:
a) moléculas representadas.
b) átomos representados.
c) elementos químicos.
d) é uma substância pura simples, composta ou uma mistura?

18 - (PUC-MG) Observe os sistemas ao lado onde as esferas representam átomos. Sobre esses sistemas, a afirmação incorreta é:
a) II contém uma substância pura
b) III contém uma mistura
c) I contém duas substâncias simples
d) II contém uma mistura
e) I contém uma mistura.
(A) C3H6 (B) C3H8 (C) C9H8 (D) C11H18 (E) C11H24
20 – Analise as estruturas moleculares de cada um dos açúcares a seguir e responda às questões sobre eles:
a) Quantos átomos tem cada um desses açúcares?
b) Quantos tipos de elementos tem cada um deles?
c) Conte os carbonos, os oxigênios e os hidrogênios de cada um desses açúcares. O que você descobriu?
d) Qual a diferença entre esses dois açúcares?
21 - Classifique os sistemas abaixo em:
b) somente O2, H2 e O3 são substâncias simples.
c) todas são substâncias compostas.
d) somente CO2, CaO e S8 são substâncias compostas.
e) as substâncias O2, H2, Pb, O3 e S8 são simples.
13 - (UF-SC) Na natureza, as três classes gerais em que todas as formas de matéria podem ser divididas são: elementos, substâncias e misturas. Dados os materiais:
I. Ouro
II.Leite
III. Cloreto de sódio
quais deles constituem, respectivamente, uma mistura, uma substância e um elemento ?
a) I, II, III
b) II, III, I
c) II, I, III
d) III, I, II
e) I, III, II
14 - (FGV) Assinale a alternativa que preenche corretamente as lacunas.
“Sendo C4H8O a fórmula molecular da butanona, pode-se afirmar que há treze ....................... em cada ............................ da referida substância.”
a) átomos – molécula
b) moléculas - átomo
c) íons – molécula
d) moléculas - íon
e) átomos – íon
15 - (CESGRANRIO-RJ) A molécula da água apresenta:
a) uma molécula de hidrogênio e meia molécula de oxigênio.
b) uma molécula de hidrogênio e um átomo de oxigênio.
c) dois átomos de hidrogênio e um átomo de oxigênio.
d) meia molécula de hidrogênio e meia molécula de oxigênio.
e) as substâncias hidrogênio e oxigênio.
16 - Dado o sistema:

qual é o número de:
a) moléculas representadas.
b) átomos representados.
c) elementos químicos.
d) é uma substância pura simples, composta ou uma mistura?
17 - A figura esquemática abaixo, representa os componentes do álcool etílico. A quantidade de átomos e a quantidade de elementos químicos presentes são respectivamente:

18 - (PUC-MG) Observe os sistemas ao lado onde as esferas representam átomos. Sobre esses sistemas, a afirmação incorreta é:
a) II contém uma substância pura
b) III contém uma mistura
c) I contém duas substâncias simples
d) II contém uma mistura
e) I contém uma mistura.
19 - (ETEC) Existem diferentes formas de se representar um composto, entre elas, a fórmula estrutural e a molecular. Observe, a seguir, a fórmula estrutural condensada do feromônio de trilha das formiguinhas de jardim:
(A) C3H6 (B) C3H8 (C) C9H8 (D) C11H18 (E) C11H24
20 – Analise as estruturas moleculares de cada um dos açúcares a seguir e responda às questões sobre eles:
a) Quantos átomos tem cada um desses açúcares?
b) Quantos tipos de elementos tem cada um deles?
c) Conte os carbonos, os oxigênios e os hidrogênios de cada um desses açúcares. O que você descobriu?
d) Qual a diferença entre esses dois açúcares?
21 - Classifique os sistemas abaixo em:
a) substância pura simples -ss
b) substância pura composta -sc
c) mistura homogênea -ho
d) mistura heterogênea - he
- água pura H2O
- sangue
- álcool – C2H5OH
- pouco sal + H2O
- leite
- leite
- café
- gás carbônico – CO2
- gás carbônico – CO2
- gás nitrogênio – N2
- ar atmosférico
- ar atmosférico
- água de torneira
- granito
- granito
- gelatina
- vapor d’água
- vapor d’água
- açúcar (pouco) + água
- refrigerante
- refrigerante
- água + óleo
- água + terra
22 - Considerando os sistemas listados a seguir, some os números do que for correto.
I. água e óleo de cozinha
II. água e cloreto de sódio
III. água e álcool (etanol)
01. Os componentes do sistema I formam uma mistura heterogênea líquido-líquido.
02. Os componentes dos sistemas II e III formam misturas homogêneas sólido-líquido e líquido-líquido, respectivamente.
04. Os componentes da mistura I formam um sistema trifásico (de três fases).
08. Os componentes da mistura II formam um sistema monofásico (uma fase).
- água + terra
22 - Considerando os sistemas listados a seguir, some os números do que for correto.
I. água e óleo de cozinha
II. água e cloreto de sódio
III. água e álcool (etanol)
01. Os componentes do sistema I formam uma mistura heterogênea líquido-líquido.
02. Os componentes dos sistemas II e III formam misturas homogêneas sólido-líquido e líquido-líquido, respectivamente.
04. Os componentes da mistura I formam um sistema trifásico (de três fases).
08. Os componentes da mistura II formam um sistema monofásico (uma fase).
Total da soma dos números: _______