Exercícios sobre Mudanças de Estado Físico
Antes de começarmos os exercícios sobre mudanças de estado físico, vamos relembrar a matéria de uma forma muito agradável. A paródia da professora Cristiane Marques vem fazer uma revisão rápida e eficiente:
https://www.youtube.com/watch?v=Nr3a77SAde8
Vamos aos trabalho!
1 –
Complete corretamente as lacunas usando os estados físicos SÓLIDO, LÍQUIDO,
GASOSO:
A)
Na solidificação, a matéria sai do estado _______________ e passa para o estado
___________________
B)
Na fusão, a matéria sai do estado _____________________ e passa para o estado
__________________
C)
Na condensação, a matéria sai do estado __________________ e passa para o
estado _______________
D)
Na vaporização, a matéria sai do estado __________________ e passa para o
estado ________________
E)
Na sublimação, a matéria sai do estado ___________________ e passa para o
estado _______________
F)
Na ressublimação, a matéria sai do estado _________________ e passa para o
estado _______________
2 - Faça a correspondência correta entre as duas colunas:
(A) Solidificação ( ) Passagem do estado sólido para o líquido
(B) Fusão ( ) Passagem do estado líquido para sólido
(C) Vaporização ( ) Passagem do estado líquido para gasoso
(D) Condensação ( ) Passagem do estado gasoso para líquido
(E) Sublimação ( ) Passagem do estado gasoso para sólido
(F) Ressublimação ( ) Passagem do estado sólido para gasoso
3 –
Complete o esquema colocando o nome das mudanças de estado físico que ocorrem
em cada situação:
I – __________________________
II - __________________________
III - __________________________
IV- __________________________
V - __________________________
VI- __________________________
4 - Analise as figuras abaixo e indique qual é o estado físico da matéria sugerido em cada um dos esquemas e JUSTIFIQUE:
www.brainly.com.br
5 - Em cada uma das situações a seguir, dê o nome das mudanças físicas que acontecem:
a) O gelo derretendo:
b) O ouro sendo fundido:
c) A formação das nuvens:
d) A formação da chuva:
e) A formação do granizo:
f) A formação da geada:
g) A formação do orvalho:
h) A formação da serração:
i) A roupa secando no varal:
j) A água fervendo:
k) O suor refrescando o corpo:
l) O espelho do banheiro ficando embaçado durante o banho:
m) A naftalina desaparecendo dentro da gaveta:
n) O gelo seco utilizado durante shows e peças de teatro:
6 - Em 2010, o inverno foi uma estação muito seca, em que
a umidade relativa do ar esteve várias vezes em situação
de alerta, por isso foi recomendado que as práticas
esportivas fossem realizadas pela manhã e suspensas
no período da tarde, quando a situação era mais grave.
Entre outros problemas, tivemos também o acúmulo de
poluentes na atmosfera, como os gases monóxido de
carbono, ozônio, óxidos de enxofre, óxidos de nitrogênio
e material particulado, o que agrava os problemas
respiratórios.
A diminuição das chuvas, neste inverno, comprova uma
interferência no ciclo da água.
Considere a figura.
https://www.vestibulinhoetec.com.br/download/prova_ant/77.pdf
Sobre o ciclo da água e sobre as substâncias mencionadas no texto, é válido afirmar que
(A) a água é dispensável para a realização da fotossíntese.
(B) no ciclo da água são encontrados somente dois estados físicos da matéria.
(C) a água da chuva retira os poluentes da atmosfera intensificando o efeito estufa.
(D) no ciclo da água ocorrem apenas duas mudanças de estados físicos: fusão e liquefação.
(E) as moléculas de água encontradas na chuva, na neve, no solo e na atmosfera são iguais entre si.
7 - Da água do mar se obtém o sal de cozinha. Para isso,
é utilizado um processo de separação de misturas
conhecido como _________, que envolve a mudança
de estado físico da água denominado _________.
As lacunas desse texto são corretamente
preenchidas, respectivamente, com
(A) solidificação e ebulição.
(B) solidificação e vaporização.
(C) fusão fracionada e ebulição.
(D) cristalização fracionada e vaporização.
(E) cristalização fracionada e destilação fracionada.
8 - O processo de destilação de bebidas surgiu no
Oriente e só foi levado para a Europa na Idade
Média. Esse processo proporcionava teores alcoólicos
mais altos do que os obtidos por meio
da fermentação, o que fez com que os destilados
passassem a ser considerados também remédios
para todo tipo de doença.
(Adaptado de: acessado em: fev. 2007.)
(A) sólido ... ebulição
(B) sólido ... sublimação
(C) sólido ... vaporização
(D) líquido ... liquefação
(E) líquido ... evaporação
10 -
De acordo com o texto, é correto afirmar que
(A) somente as substâncias puras apresentam
temperatura de fusão constante.
(B) somente as misturas eutéticas apresentam ponto
de fusão constante.
(C) a fusão é a passagem do estado sólido para o estado
gasoso.
(D) o nome mistura eutética significa mistura fácil de
fundir.
(E) o processo mencionado é um processo químico.
11 - No ambiente, a água apresenta-se nos estados
sólido, líquido e gasoso, estando em constante interação
com o solo, com a atmosfera, com a flora e com a fauna.
A compreensão desta interação não é simples, pois a
água muda de estado em determinadas ocasiões.
No desenho temos uma representação simplificada do
ciclo da água.
As mudanças de estados físicos que acontecem em
1, 2 e 3 são, respectivamente,
(A) sublimação, condensação e evaporação.
(B) ebulição, condensação e evaporação.
(C) ebulição, condensação e condensação.
(D) evaporação, liquefação e sublimação.
(E) condensação, condensação e evaporação.
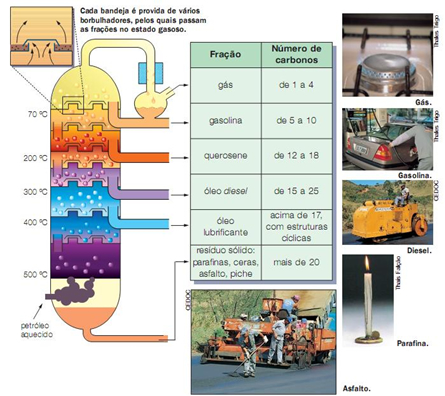
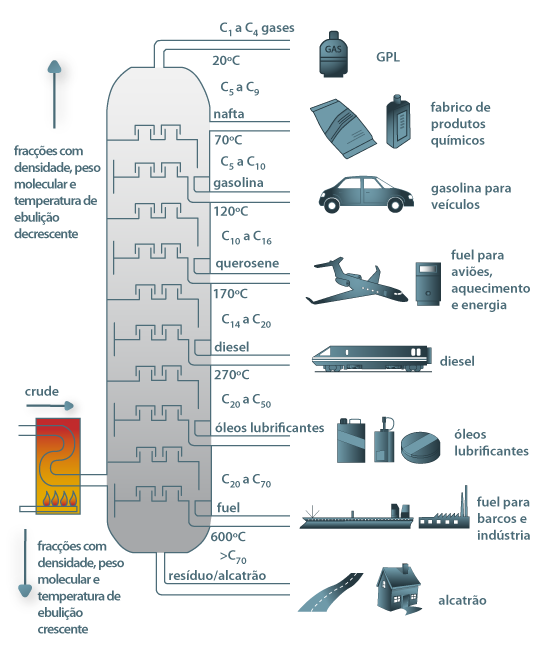
12 - A figura abaixo está relacionada à obtenção das diferentes substâncias a partir da destilação do petróleo:
http://labvirtual.eq.uc.pt
Sobre os processos representados nessa figura, coloque F (falso) e V (verdadeiro) nas afirmativas a seguir:
A - ( ) O petróleo é uma mistura de substâncias
B - ( ) Para separar as substâncias que formam o petróleo é utilizada a propriedade do ponto de fusão
C - ( ) Os pontos de ebulição e condensação de cada substância é diferentes, e essas propriedades são utilizadas nas refinarias de petróleo
D - ( ) Para que a separação de substâncias na torre de fracionamento, os vapores vão encontrando temperaturas cada vez menores que o ponto de ebulição para se condensarem
E - ( ) Na figura, o ponto de ebulição da gasolina é menor do que 40ºC
F - ( ) O ponto de ebulição do óleo diesel é maior do que 270ºC
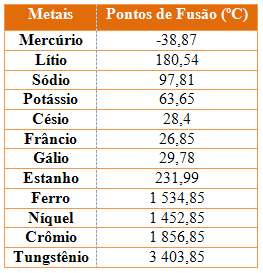
13 - Considere a tabela de pontos de fusão e ebulição das substâncias a seguir:
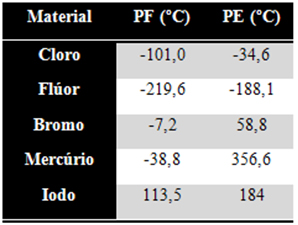
www.exerciciosbrasilescola.com
A 50ºC, encontram-se no estado líquido:
a) cloro e flúor.
b) cloro e iodo.
c) mercúrio e iodo.
d) flúor e bromo.
e) bromo e mercúrio.
14 - O ponto de fusão do ferro é igual a 1530 ºC e o ponto de ebulição é de 2 450ºC. Baseado nisso, qual será o estado físico do ferro nas seguintes temperaturas:
a) 25 ºC:
b) 130 ºC:
c) 1 459 ºC:
d) 2 235 ºC:
e) 3 002 ºC:
15 - Observe a tabela abaixo e identifique quais estão sólidos em temperatura ambiente (considere 20 ºC como a temperatura ambiente) e pressão de 1 atm:
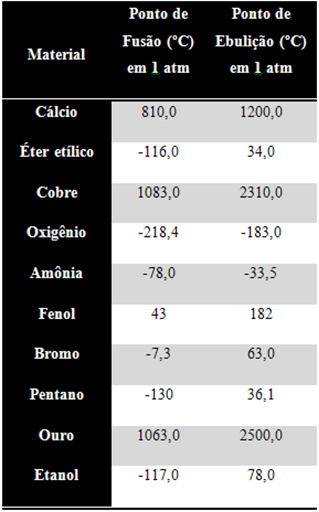
www.exerciciosbrasilescola.com
b) Éter, bromo, pentano e etanol.
c) Fenol, bromo e ouro.
d) Oxigênio, amônia e fenol.
e) Cálcio, cobre, fenol e ouro
I – Uma pedra de naftalina deixada no armário;
II – Uma vasilha de água deixada no freezer;
III- Uma vasilha de água deixada no fogo;
IV – O derretimento de um pedaço de chumbo quando aquecido;
Nesses fatos estão relacionados corretamente os seguintes fenômenos:
a) I. Sublimação; II. Solidificação; III. Evaporação; IV. Fusão.
b) I. Sublimação; II. Sublimação; III. Evaporação; IV. Solidificação.
c) I. Fusão; II. Sublimação; III. Evaporação; IV. Solidificação.
d) I. Evaporação; II. Solidificação; III. Fusão; IV. Sublimação.
e) I. Evaporação; II. Sublimação; III. Fusão; IV. Solidificação.
17 -

Pela análise dos dados da tabela, medidos a 1 atm, podemos afirmar que à temperatura de 40 ºC e 1 atm:
a) O éter e o etanol encontram-se na fase gasosa.
b) O éter se encontra na fase gasosa e o etanol na fase líquida.
c) Ambos encontram-se na fase líquida.
d) O éter encontra-se na fase líquida e o etanol na fase gasosa.
e) Ambos se encontram na fase sólida.
b) O éter se encontra na fase gasosa e o etanol na fase líquida.
c) Ambos encontram-se na fase líquida.
d) O éter encontra-se na fase líquida e o etanol na fase gasosa.
e) Ambos se encontram na fase sólida.
18 - Em uma bancada de laboratório existem cinco frascos fechados com rolha comum que contêm, separadamente, os seguintes líquidos:
Num dia de muito calor, em determinado instante, ouve-se no laboratório um estampido, produzido pelo arremesso da rolha de um dos frascos para o teto.
De qual dos frascos foi arremessada a rolha?
a) 1
b) 2
c) 3
d) 4
e) 5
Explique o motivo de sua escolha.
19 - Colocando-se água bem gelada em um copo de vidro, em pouco tempo ele fica molhado por fora, devido à formação de gotas de água. Explique como ocorre esse fenômeno.
20 - O período da seca é caracterizado pela ausência de chuvas, por isso também conhecido como estiagem. Em algumas regiões , como no centro oeste do Brasil, por exemplo, este período é bem notório, pois afeta o própria saúde dos moradores. Dentre as principais queixas está a dificuldade de respirar em algums casos, ocorre até mesmo o sangramento nas narinas. apresentamos aqui uma solução caseira, para amenizar o problema: espalhe pelos comodos da casa recipientes abertos contendo água. Mas o que acontece com essa água e porque o método se torna eficaz nesse caso?
21 - Por que, na panela de pressão, os alimentos cozinham mais rápido?
22 - Por que quando colocamos a panela de pressão sob a água da torneira na pia, a pressão sai mais rápido?
23 - Analise as figuras A e B abaixo e diga o que vai acontecer em cada um dos casos se mantivermos os recipientes no fogo. Justifique suas respostas.

www.wallison1.blogspot.com
24 - Observe a figura a seguir para responder as questões que a seguem:
www.revistaescola.abril.com.br
a) No ponto mais baixo ou no ponto mais alto a pressão do ar é maior? Por que isso acontece?
b) Para cozinhar sua refeição, onde o alpinista levaria menos tempo para ver a água entrar em ebulição: no baixo ou no alto?
c) Onde o alpinista sentiria mais frio? Por quê?
25 - Analise a figura do destilador simples abaixo e responda as questões que a segue:
Explique quais são os fenômenos que estão acontecendo nos pontos A, B, C do experimento acima.
Resolva também as seguintes listas de exercícios:
http://www.jardimsaopaulo.com.br/pdf/9anos_exercicios_estados_fisicos.pdf
http://www.jardimsaopaulo.com.br/pdf/exercicios_sobre_graficos_de_estado_fisico.pdf