Propriedades Específicas Físicas da Matéria 2 - Mudanças de Estado Físico e os Pontos de Fusão, Solidificação, Ebulição e Condensação
Videoaula da professora Jack:
Como já vimos na postagem anterior, o calor afeta muito as partículas, agitando-as e tendo como consequência as mudanças de estado físico. Nesta postagem, vamos estudar mais detalhadamente essas mudanças e conhecer vários exercícios relacionados.
Com o ganho ou a perda de calor, a matéria muda seu estado físico. Essas mudanças têm nomes específicos:
- Mudança do sólido para o líquido = FUSÃO
- Mudança do líquido para o gasoso = VAPORIZAÇÃO
- Mudança do gasoso para o líquido = CONDENSAÇÃO OU LIQUEFAÇÃO
- Mudança do líquido para o sólido = SOLIDIFICAÇÃO
Ainda existe a mudança do estado sólido para o gasoso, que é chamado de SUBLIMAÇÃO e do gasoso diretamente para o sólido, que tem recebido vários nomes como SUBLIMAÇÃO, RESSUBLIMAÇÃO, SUBLIMAÇÃO INVERSA (CRISTALIZAÇÃO) e assim por diante. Para efeito de nossos estudos, assumiremos o termo ressublimação quando a mudança for do estado gasoso para sólido.
Observe as figuras a seguir para compreender melhor:
www.pt.wikipedia.org
www.blogdoenem.com.br
Vamos estudar cada uma dessa mudanças de estado físico.
Fusão
Toda vez que uma substância no estado sólido recebe calor, sua partículas se reorganizam e ganham movimento, passando para o estado líquido. As pessoas chamam fusão de derretimento. No caso do gelo, para que ele passe do estado sólido para líquido, ou seja, para que ele sofra fusão, ele tem que estar a 0 de temperatura e continuar ganhando calor. Já o ouro, sofre fusão a partir de 1.064ºC, o ferro 1.535ºC, álcool -114ºC, hidrogênio -259ºC, etc. Cada substância tem a sua temperatura de sofrer fusão. Essa temperatura é chamada de PONTO DE FUSÃO (PF), que é uma propriedade específica física da matéria.
O ponto de fusão é a temperatura na qual a matéria se mantém enquanto está saindo do estado sólido e indo para o líquido. Vamos usar o exemplo do gelo.
Quando o gelo chega à temperatura 0, sob a pressão atmosférica ao nível do mar, todo o calor oferecido ao gelo é usado para reorganizar as partículas da água e assim promover a mudança de sólido para líquido. Até que todo o gelo não esteja no estado líquido, mesmo fornecendo calor, a temperatura não mudará, continuará 0, passando a aumentar apenas após todo o gelo ter se tornado líquido.
Observe o gráfico a seguir referente à fusão de uma substância qualquer:
www.sobiologia.com.br
No gráfico, a temperatura continua a mesma enquanto está ocorrendo a fusão, aumentando apenas quando todo sólido tiver passado para o estado líquido.
Vamos conhecer alguns pontos de fusão e discutir sobre eles:
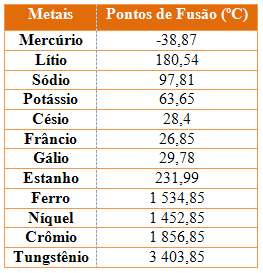
O ponto de fusão do mercúrio é quase 39ºC abaixo de zero. Considerando que a temperatura média de onde vivemos é por volta de 20 - 25ºC, o mercúrio já sofreu fusão, ou seja, já saiu do estado sólido e encontra-se no estado líquido. Devido a isso, o mercúrio é o único metal encontrado no estado líquido nas temperaturas normais de nosso planeta. As emias substâncias são comumente encontradas no estado sólido em nosso planeta, pois seus pontos de fusão são temperaturas superiores daquelas encontradas no dia-a-dia, com devidas restrições ao césio, frâncio e gálio, que em dias muito quentes, podem ser encontrados no estado líquido.
Vamos conhecer alguns pontos de fusão e discutir sobre eles:

www.alunosonline.com.br
O ponto de fusão do mercúrio é quase 39ºC abaixo de zero. Considerando que a temperatura média de onde vivemos é por volta de 20 - 25ºC, o mercúrio já sofreu fusão, ou seja, já saiu do estado sólido e encontra-se no estado líquido. Devido a isso, o mercúrio é o único metal encontrado no estado líquido nas temperaturas normais de nosso planeta. As emias substâncias são comumente encontradas no estado sólido em nosso planeta, pois seus pontos de fusão são temperaturas superiores daquelas encontradas no dia-a-dia, com devidas restrições ao césio, frâncio e gálio, que em dias muito quentes, podem ser encontrados no estado líquido.
Mais uma coisa: vamos analisar com mais atenção o ponto de fusão do álcool. O álcool é uma substância que para ser encontrada no estado sólido tem que estar a uma temperatura mais baixa que 114ºC negativos. A partir dessa temperatura e subindo, as partículas do álcool ganham calor e ele passa para o estado líquido. Como no planeta Terra não temos temperaturas mais baixas que 114ºC negativos, não vemos aqui o álcool no estado sólido, apenas no estado líquido e na gososo.
Os freezeres podem chegar a -20ºC ou até um pouco menos, mas mesmo assim, não chegam a -114ºC, portanto, não congelam o álcool. Devido a isso, bebidas com teores alcoólicos altos (maior que 40%) não congelam.
A fusão é um fenômeno físico observado em nosso dia-a-dia quando retiramos o gelo de dentro do congelador, quando a parafina da vela acesa derrete, quando as geleiras derretem devido ao aquecimento global, etc.
Vaporização
A vaporização pode ocorrer sob três formas:
- Vaporização do tipo EBULIÇÃO: o líquido recebe calor o suficiente para ferver, borbulhar, liberando bolhas de gases. A água ferve a 100ºC ao nível do mar, enquanto o ferro a 3.000ºC, o metal líquido mercúrio a 357ºC, já o oxigênio, entra em ebulição a -183ºC e assim por diante. Cada substância entra em ebulição em uma temperatura específica ao nível do mar e essa temperatura é chamada de PONTO DE EBULIÇÃO (PE), que é uma propriedade específica da matéria.
Assim como no ponto de fusão, a temperatura se mantém constante durante todo o processo de ebulição, enquanto houver líquido passando para o estado gasoso. Depois da mudança de estado físico de líquido para gasoso, é que a temperatura continua a subir, devido ao ganho de calor.
www.sobiologia.com.br
Vamos conhecer alguns pontos de ebulição de algumas substâncias.

www.senosecossenos.com.br
Novamente, preste atenção ao álcool. Seu ponto de ebulição é 78ºC. Isso significa que, para que o álcool ferva, faça bolhas e vaporize rapidamente, é necessária a temperatura de 78ºC. Não que ele não evapore a temperaturas mais baixas, mas nesses casos, a vaporização é mais lenta, do tipo evaporação.
Atenção também ao hidrogênio. Seu ponto de fusão é 259ºC negativos, ou seja, nessa temperatura baixíssima, ele passa do estado sólido para líquido e, para ferver e vaporizar rapidamente, ele precisa de 253ºC negativos. Portanto, a 25ºC ele está no estado de vapor.
Analisando os pontos de fusão e ebulição das substâncias é possível dizer se aqui na Terra elas se encontram no estado sólido, ou no líquido ou no gasoso.
Outro fator importante a ser considerado quando estudamos os pontos de fusão e ebulição é a influência da pressão.
Segundo as informações disponíveis no link http://www.alunosonline.com.br/fisica/influencia-pressao-na-temperatura-fusao-ebulicao.html, experimentalmente foi verificado que quando há variação de pressão sobre uma determinada substância, a temperatura na qual ela muda de fase sofre alterações. Sendo assim, é preciso sempre lembrar que o gelo se funde a 0 ºC e a água entra em ebulição a uma temperatura de 100 ºC, quando a pressão local é de 1 atmosfera.
Outro fator importante a ser considerado quando estudamos os pontos de fusão e ebulição é a influência da pressão.
Segundo as informações disponíveis no link http://www.alunosonline.com.br/fisica/influencia-pressao-na-temperatura-fusao-ebulicao.html, experimentalmente foi verificado que quando há variação de pressão sobre uma determinada substância, a temperatura na qual ela muda de fase sofre alterações. Sendo assim, é preciso sempre lembrar que o gelo se funde a 0 ºC e a água entra em ebulição a uma temperatura de 100 ºC, quando a pressão local é de 1 atmosfera.
Influência da pressão na temperatura de fusão
Quando uma substância qualquer se funde, ou seja, passa do estado sólido para o estado líquido, ela tem seu volume aumentado. Para uma substância com esse comportamento, observa-se que um aumento na pressão exercida sobre ela acarreta um aumento em sua temperatura de fusão.
Algumas poucas substâncias, entre as quais a água, fogem do comportamento geral, diminuindo de volume ao se fundirem. Portanto, o volume de uma dada massa de água aumenta quando ela se transforma em gelo. É por esse motivo que uma garrafa cheia de água, colocada em um congelador, quebra quando a água se solidifica.
Para essas substâncias, ditas anômalas, um aumento na pressão acarreta uma diminuição na temperatura de fusão. Como sabemos, o gelo se funde a 0 ºC somente se a pressão sobre ele for de 1 atm. Se aumentarmos essa pressão, ele se fundirá a uma temperatura inferior a 0 ºC; e, reciprocamente, a uma pressão inferior a 1 atm, sua temperatura de fusão será superior a 0 ºC.
Influência da pressão na temperatura de ebulição
Sabemos que a vaporização se dá pelo fato de as partículas do líquido adquirirem altas velocidades e conseguirem escapar do líquido. Dessa forma, quando há aumento na pressão há também um aumento na temperatura de ebulição, pois, com pressão mais elevada, a vaporização se torna mais difícil, uma vez que, por conta da pressão, as partículas que tendiam a sair do líquido voltam à superfície dele.
Podemos então dizer que é graças a esse fenômeno que as panelas de pressão puderam ser desenvolvidas. Como sabemos, qualquer substância quando se vaporiza tem seu volume aumentado. Em uma panela aberta, com pressão de 1 atm, a água entra em ebulição a 100 ºC e sua temperatura não ultrapassa esse valor. Na panela de pressão, os vapores formados e impedidos de escapar ajudam a pressionar a superfície da água, podendo a pressão total atingir cerca de 2 atm. Com isso, a água só entrará em ebulição por volta dos 120 ºC, fazendo com que os alimentos sejam cozidos mais rapidamente.
- Vaporização do tipo EVAPORAÇÃO: a matéria no estado líquido passa para o estado gasoso de forma relativamente lenta, sem formação de bolhas. É o que ocorre com a água da roupa molhada no varal, ou com a água da chuva que caiu no asfalto ou ainda com a água presente em seu suor, etc.
Aliás, o suor é produzido quando, por algum motivo, o corpo aquece, por exemplo, durante a execução de atividades físicas. Como forma de manutenção da temperatura corpórea em equilíbrio, as glândulas sudoríparas liberam o suor sobre a pele. O suor é feito de água e sais minerais. A água do suor absorve o calor do corpo e evapora, desaparecendo do corpo e das roupas. Já os sais minerais não evaporam com o calor de nosso corpo ou calor do sol, devido a isso, após transpiramos, nossa pele fica levemente salgada. O fato do suor absorver calor do corpo faz com que o corpo perca calor, diminuindo a temperatura, deixando-a normal, como mostra a figura a seguir:
www.fisioex2013.blogspot.com.br
- Vaporização do tipo CALEFAÇÃO: A calefação, nome popular para o Efeito de Leidenfrost é a vaporização que ocorre quando um líquido entra em contato com uma superfície que se encontra a uma temperatura muito maior que a temperatura de ebulição do líquido (acima de 100ºC no caso da água). Durante a calefação o líquido se divide em pequenas esferas, que executam um movimento rápido e desordenado sobre a superfície que lhes fornece calor à medida que diminuem de volume. Quando molhamos o dedo em saliva e o encostamos no ferro de passar, ocorre calefação, por exemplo.
A vaporização é um fenômeno físico muito comum em nosso dia-a-dia: quando a chuva evapora e sobe ao céu, quando a roupa seca no varal, quando colocamos água para ferver no fogão, quando deixamos um vidro de álcool ou acetona abertos, quando o suor seca em nosso corpo ou de nossas roupas, etc.
Sublimação
Nessa mudança de estado, o que está no estado sólido passa para o estado gasoso diretamente, sem passar pelo estado líquido. Isso acontece por exemplo com a naftalina.
www.agracadaquimica.com.br
A naftalina (C10H8) é uma substância tóxica para traças e baratas além de alguns micro-organismos. Quando colocada nas gavetas e armários, as bolinhas vão diminuindo, diminuindo até desaparecerem. Saem do estado sólido diretamente para o estado gasoso, sofrendo sublimação. Cuidado! Naftalina é tóxica também para as pessoas!
Outro exemplo de sublimação é do gelo seco. O gelo seco nada mais é do que gás carbônico resfriado e prensado.
O gás carbônico sofre ebulição a -55ºC, portanto, na Terra, com as temperaturas existentes, não há como o gelo seco ficar no estado líquido.
Condensação
Nessa mudança de estado físico, a matéria que está no estado gasoso, perde calor e agitação e passa para o estado líquido. As moléculas se aproximam, ficando "mais densas", daí o termo condensação.
A condensação é observada em várias situações cotidianas. Quando cozinhamos arroz, a água evapora e fica presa dentro da panela. O vapor não tem por onde sair e acaba sendo pressionado dentro da panela. Então as moléculas se aproximam e passam do estado gasoso para o líquido na parte de dentro da tampa.
Quando chove e o sol aquece a água da chuva, ela evapora sobe ao céu e lá condensa formando nuvens. As nuvens são constituídas de gotículas de água. Caso ocorra a passagem de uma frente fria, essas gotículas condensam-se ainda mais e a chuva cai (precipitação).
O orvalho também é um fenômeno natural ligado à condensação. O vapor de água presente no ar perde temperatura à noite ou na aurora e condensa-se em gotas de água que molham carros, jardins, grama, etc.
Quando respiramos perto de um espelho, percebemos que o embaçamos. Isso acontece porque de nossa expiração sai gás carbônico junto com vapor de água. Esse vapor de água sai de nós na temperatura por volta de 37ºC e, ao encontrar um espelho com temperatura inferior, perde calor e agitação e sai do estado de vapor e passa para o estado líquido, embaçando o espelho.
Iberê Thenório do Manual do Mundo traz algumas dicas interessantes sobre como não deixar o vidro do carro não embaçar em dia de chuva:
https://www.youtube.com/watch?v=vOWd7XW9X_I
Na panela de pressão também ocorre condensação:
www.ddsonline.com.br
Primeiro a água recebe calor e evapora. Parte do vapor sai pela válvula com pino. Outra parte fica presa na panela e, através da pressão, acaba sofrendo condensação (vapor para líquido).
Como as moléculas ficam sob forte pressão dentro da panela, elas ficam "sem espaço" para muita agitação, havendo absorção de mais calor para a ebulição, o que faz com que, dentro da panela de pressão, a temperatura chegue a 125ºC.
Quando se quer retirar a pressão da panela de forma mais rápida, basta colocá-la sob a água da torneira na pia da cozinha. A água da torneira, retira calor da panela e consequentemente do vapor, então ele condensa e, na forma líquida, a água não faz pressão dentro da panela.
Solidificação
É a passagem do estado líquido para sólido quando há perda de calor. Quando a água é colocada dentro do congelador, suas moléculas perdem calor e, consequentemente, agitação, aproximam-se e organizam-se passando para o estado sólido = gelo.
Normalmente, com as demais substâncias, quando passam para o estado sólido, a aproximação das moléculas tende a gerar um aumento na densidade, devido à diminuição do volume. Dizendo de outra maneira: conforme as moléculas vão se aproximando e se organizando, elas ocupam menos espaço no estado sólido e, diminuindo o volume, aumenta a densidade (volume é inversamente proporcional à densidade).
Mas, no caso da água, isso não acontece. Veja na figura:

www.educacao.uol.com.br
Quando a água se solidifica, suas moléculas se organizam formando hexágonos que, espacialmente ocupam maior volume. Devido a isso, não podemos deixar garrafas cheias de água, sucos, refrigerantes, chás, etc dentro do congelador, pois a água expande ao passar de estado sólido.
Devido a isso também, o gelo tem densidade menor que a da água em estado líquido e flutua nela. Veja os icebergs, gigantescos blocos de gelo que flutuam sobre as águas do mar.

www.sciencehowstuffworks.com
E a água salgada, congela?
Veja o exemplo dos icebergs. Neles, há muitas vezes, apenas água doce (com baixa concentração de sais). O sal (cloreto de sódio) dissolvido na água faz com que a temperatura de solidificação da mistura caia para 20ºC abaixo de zero. Portanto, para que a água salgada congele é necessária temperatura abaixo de 20ºC negativos.
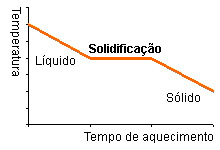
www.sobiologia.com.br
É necessário que haja perda de calor, daí a queda da temperatura, não esquecendo que, quando uma substância está se solidificando, ela permanece na mesma temperatura até que toda ela se solidifique. Devido a isso, no congelador, o gelo começa a se formar de fora para dentro do cubinho, perdendo calor primeiramente na superfície e depois em seu interior. Sendo assim, os lagos congelados congelam a superfície e geralmente, mantêm-se líquidos a partir de certa profundidade.Ressublimação ou sublimação invertida
Você já presenciou o fenômeno da geada?
A geada é algo realmente interessante de se ver! Você levanta cedo em um dia bem frio e nota que a grama de casa está toda branquinha, cheia de cristais de gelo ou que sobre o capô do carro está uma fina camada de gelo.
A geada acontece devido ao fenômeno da ressublimação, onde a substância em estado gasoso passa para o sólido sem passar pelo estado líquido antes.
Assista ao interessante experimento a seguir onde é possível verificar várias mudanças de estado físico sofridas pela naftalina, inclusive a ressublimação.
https://www.youtube.com/watch?v=U1KyiKPa384
Entenda que, ao fornecer calor para a naftalina, parte dela sofreu fusão, parte sublimou, saindo do sólido para o gasoso e depois, parte dela ebuliu, saindo do líquido para o gasoso. Os vapores são vistos dentro do becker que fica todo embaçado. Quando a naftalina na forma de vapor encontra o placa de Petri gelada que foi colocada sobre o becker, ele passa diretamente para o estado sólido, formando os cristais de naftalina, ou seja, sofre ressublimação (do gasoso para o sólido).
Um caso abordado de maneiras diversas nos livros e sites é a formação da neve. Algumas publicações colocam a formação da neve como sendo um exemplo de solidificação (do líquido para sólido), outros colocam como sendo um exemplo de condensação (do vapor para o líquido?).
Após uma pesquisa realizada na internet, este blog assume a explicação disponível no link http://revistaescola.abril.com.br/fundamental-2/quais-sao-condicoes-climaticas-necessarias-haver-neve-679014.shtml:
"Não basta uma cidade ter temperaturas baixas em determinado dia para nevar. É preciso que as nuvens estejam úmidas e que tanto a temperatura da atmosfera como a temperatura do solo estejam baixas (em torno de zero grau ou menos). Além disso, é essencial que todo o caminho percorrido pelo vapor d'água que sobe até as nuvens (para formar os cristais de neve) e o que desce (já com ela formada) esteja gelado para que os cristais não derretam, se transformando em chuva. No Brasil, as raras precipitações de neve ocorreram em pontos serranos dos estados do Paraná, de Minas Gerais, do Rio de Janeiro, de São Paulo, do Rio Grande do Sul e de Santa Catarina. Cidades localizadas em altitudes acima de 1.250 metros e ao sul do Brasil, como a catarinense São Joaquim e a gaúcha São José dos Ausentes, sofrem influência das massas de ar vindas do polo Sul e, por isso, registram neve com mais frequência."

Como a explicação fala de vapor de água transformando-se em cristais de neve, assume-se aqui que a formação da neve é um fenômeno ligado à ressublimação e não à solidificação ou condensação. Mas esse assunto ainda é bastante discutível. Veja o vídeo a seguir:
https://www.youtube.com/watch?v=Zj5UKUWvWeQ
ATENÇÃO:
Nas próximas postagens, mais um pouco sobre mudança de estado físico além de vários exercícios para você estudar.
Caso você tenha ficado com dúvidas após estudar tudo isso, use as videoaulas indicadas a seguir:
https://www.youtube.com/watch?v=nZkzTPfNpBI
https://www.youtube.com/watch?v=ldg1NLFpRSs
https://www.youtube.com/watch?v=h24_iTlxWR4
https://www.youtube.com/watch?v=lK6MEiRD2pk
https://www.youtube.com/watch?v=To2hxuf7i_M






